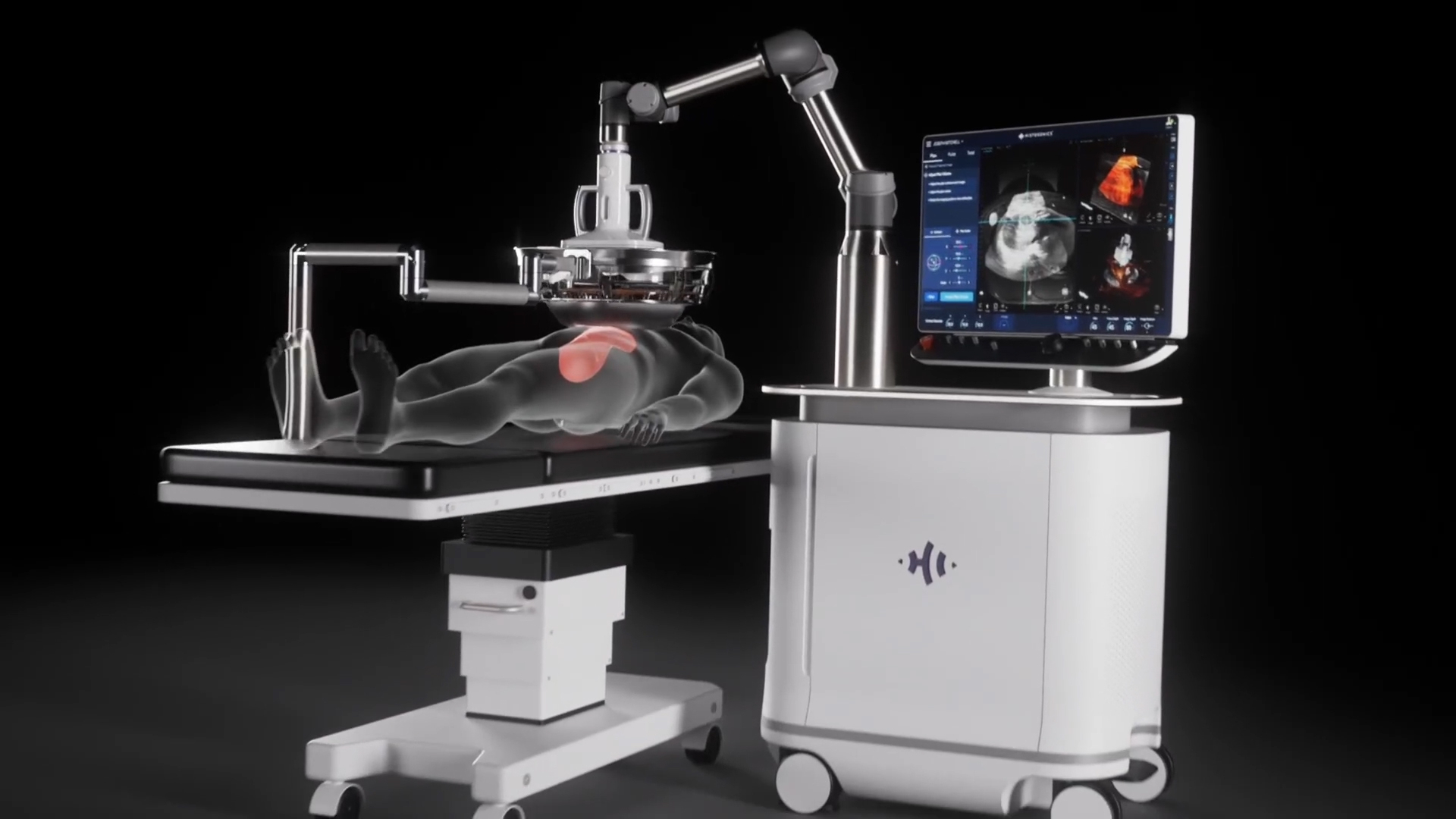
La empresa acelera los planes de lanzamiento de su plataforma denominada «Breakthrough Device»
MINNEAPOLIS–(BUSINESS WIRE)–HistoSonics®, (www.histosonics.com), fabricante del sistema Edison® y de nuevas plataformas terapéuticas de histotricia, ha anunciado hoy la autorización de comercialización de su plataforma «Breakthrough» a través del proceso de solicitud de clasificación De Novo de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA), una rigurosa revisión previa a la comercialización de productos sanitarios sin antecedentes. La autorización de comercialización convierte a Edison en la primera y única plataforma de histotricia disponible en Estados Unidos.
La autorización de la FDA se fundamentó, en parte, en los datos de los ensayos #HOPE4LIVER realizados en 13 centros de Estados Unidos y Europa.
El comunicado en el idioma original es la versión oficial y autorizada del mismo. Esta traducción es solamente un medio de ayuda y deberá ser comparada con el texto en idioma original, que es la única versión del texto que tendrá validez legal.
Contacts
Contacto con medios de comunicación:
Josh King
Vicepresidente de marketing
Correo electrónico: Joshua.king@histosonics.com
Teléfono: 608.332.8124